In einer Pressemitteilung vom 01. Mai 2019 und in einem Vortrag von Tim Miller (Biogen, USA) auf dem europäischen ALS-Kongress „ENCALS“ am 17. Mai in Tours (Frankreich) wurden die Zwischenergebnisse einer wichtigen ALS-Studie mit dem Medikament Tofersen veröffentlicht.
Tofersen ist ein genetisches Medikament des amerikanischen Arzneimittelherstellers Biogen, das gegen Mutationen im SOD1-Gen gerichtet ist. Dieses Medikament wird für ALS-Patienten entwickelt, die Mutationen im SOD1-Gen aufweisen und an einer erblichen Form der ALS (familiäre ALS, FALS) erkrankt sind. Nur im Ausnahmefall werden SOD1-Mutationen bei Patienten nachgewiesen, die keine FALS aufweisen.
Tofersen ist ein neuartiges Medikament, das über einen innovativen Therapieansatz verfügt. Es handelt sich um eine synthetisch hergestellte Abfolge weniger (wenige = oligo) DNA-Bausteine (Nukleotide), die auf eine „Abwehr“ schädlicher genetischer Veränderungen (Mutationen) abzielen. Die synthetisch hergestellten DNA-Bausteine (Oligonukleotide) werden in besonderer Weise konstruiert, dass sie der Vervielfältigung (Transkription) der schädlichen SOD1-Mutationen entgegenwirken (Antisense-Technologie). Die Gruppe neuartige Medikamente, die der genetischen „Ausschaltung“ von krankheitsverursachenden Genabschnitten dient, werden als „Antisense-Oligonukleotide“ (ASO) bezeichnet. Tofersen ist das erste ASO-Medikament, das für die Therapie der ALS entwickelt und eingesetzt wird.
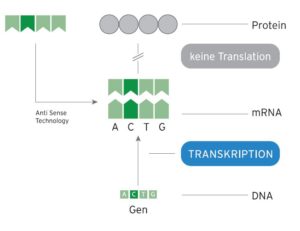
Ein Gen enthält die „Produktionsanleitung“ für die Bildung eines Eiweißes (Protein). Auf dem Weg vom Gen zum Protein (Translation) muss eine Abschrift (Transkript) des Gens hergestellt werden. Dieser Zwischenschritt wird durch die ASO-Strategieausgenutzt. Synthetisch hergestellte Genabschnitte (Oliginukleotide) werden dem Patienten verabreicht, die in gegenläufiger Weise (antisense) an die Kopie des geschädigten Gens angreifen und damit die Bildung des fehlerhaften Proteins verhindern.
Biogen (Cambridge, USA) hat sich auf die Entwicklung neurologischer Medikamente (insbesondere bei der Multiplen Sklerose, Spinalen Muskelatrophie und ALS) spezialisiert. Das Unternehmen berichtet von den Ergebnissen einer Phase 1/2-Studie von Tofersen, die als eine randomisierte, plazebo-kontrollierte Untersuchung durchgeführt wurde. An der Studie nahmen 50 ALS-Patienten teil, die Mutationen im SOD-1Gen aufweisen. Die Patienten wurden (nach einem Zufallsprinzip) fünf unterschiedlichen Studiengruppen zugeordnet (jeweils 10 Patienten): Plazebo, Tofersen 20 mg, 40 mg, 60 mg oder 100 mg. Eine Zwischenauswertung erfolgte nach 12 Wochen. In den Zwischenergebnissen wurden die Daten der 100 mg Tofersen-Gruppe (10 Patienten) im Vergleich zu den ALS-Patienten mit Plazebo-Behandlung berichtet. Die ASO-Behandlung führte zu einer signifikanten Verminderung des mutierten (und schädlichen) SOD1-Proteins im Nervenwasser (Liquor cerebrospinalis). Aufgrund der geringen Patientenzahl (10 Teilnehmer pro Gruppe) und der kurzen Beobachtungszeit (12 Wochen) konnte für die klinische Wirksamkeit noch keine statistische Signifikanz erreicht werden. Die bisherigen Ergebnisse sind jedoch vielversprechend: In der Plazebo-Gruppe nahmen die motorischen Funktionen auf der ALS-Funktionsskala (ALS-FRS) um 5,3 Skalenpunkte ab (Tag 85). Im gleichen Beobachtungszeitraum nahm die mittlere motorische Funktion der Tofersen-Gruppe (100 mg) um 1,1 Skalenpunkte ab. Ein vergleichbarer Effekt war bei der Atemfunktion nachweisbar.
Aufgrund der positiven Ergebnisse aus der Phase 1/2-Studie hat die amerikanische Arzneimittelbehörde FDA einem sofortigen Beginn einer Phase 3-Studie zugestimmt (VALOR-Studie). An dieser Studie wird eine größere Zahl an ALS-Patienten mit SOD1-Mutationen teilnehmen. Der erste Patient wurde bereits im März 2019 (in den USA) in die Studie eingeschlossen. Der Studienabschluss ist für Mitte 2020 geplant. Bei einem positiven Verlauf der Phase 3-Studie ist mit einer Zulassung von Tofersen Mitte 2021 zu rechnen.
Quelle: CHARITÉ – UNIVERSITÄTSMEDIZIN BERLIN, Charité Centrum für Neurologie, Neurochirurgie und Psychiatrie
Kontaktieren Sie zu diesem Thema:

Prof. Dr. Thomas Meyer
Facharzt für Neurologie
Ambulanzleitung
Ambulanz für ALS und andere Motoneuronenerkrankungen
Charité – Universitätsmedizin Berlin
+49 (0)30 450 560132
