14 Apr. Entwicklung eines neuen Verfahrens zur Charakterisierung und Quantifizierung der Proteinakkumulation bei der ALS
Forschungsergebnisse ALS von Christopher Secker, Pressemitteilung April 2018
Zusammenfassung des Forschungsergebnisses zu ALS
„Bei ca. 95% der ALS-Patienten lagert sich in den von der Neurodegeneration betroffenen Hirn- und Rückenmarksregionen das Protein TDP-43 ab. Dieses Protein steht im Verdacht am Fortschritt der ALS maßgeblich beteiligt zu sein. Christopher Secker hat in einem Forschungsprojekt ein neues Testverfahren entwickelt mit dessen Hilfe unter anderem die Ansammlung des TDP-43 Proteins untersucht werden kann.“
Bei ca. 95% der ALS-Patienten lagert sich in den von der Neurodegeneration betroffenen Hirn- und Rückenmarksregionen, insbesondere dort wo sich die Motoneuronen befinden (Motorischer Cortex, vorderes Spinalhorn), das RNA-bindende Protein TDP-43 ab. Es bildet eine unlösliche Akkumulation im Zellkörper von Neuronen, die in gesunden Individuen nicht oder nur sehr selten festzustellen ist.
Es ist mittlerweile bekannt, dass diese unlöslichen Proteinspezies -ähnlich wie Prion-Proteine von Prionenerkrankungen und auch wie Proteinablagerungen, die bei anderen neurodegenerativen Erkrankungen wie Parkinson, Alzheimer, Chorea Huntington vorkommen – in der Lage sind, eine Akkumulation von löslichen, noch funktionellen TDP-43 Proteinen zu induzieren. Einerseits führt dies dazu, dass das TDP-43 nicht mehr ausreichend seiner natürlichen Funktion nachgehen kann und andererseits belastet und schädigt eine starke Ablagerung fehlgefalteter Proteine andere lebenswichtige Prozesse in den betroffenen Zellen.
Die unlöslichen TDP-43 Proteinspezies in den Neuronen, die von der Proteinablagerung betroffen sind, werden zudem an ihre direkte Umgebung als auch entlang ihrer Nervenfaserverbindungen, abgegeben. Nehmen andere Zellen diese fehlgefalteten Proteine auf, wird in ihnen die Akkumulation von löslichem TDP-43 induziert. Eine verbreitete Hypothese besteht darin, dass diese Ausbreitung der unlöslichen TDP-43 Proteinspezies über das zentrale
Nervensystem für das Fortschreiten der ALS eine wichtige Rolle spielt.
Am 01. September 2016 startete ein Forschungsprojekt zur Grundlagenforschung bei der ALS in Kooperation mit dem Max-Delbrück-Centrum für molekulare Medizin (MDC, Arbeitsgruppe Erich Wanker) in Berlin und dem Deutschen Zentrum für neurodegenerative Erkrankungen (DZNE, Arbeitsgruppe Harald Prüß). Das Projekt ist für fünf Jahre angelegt und untersucht die schädlichen Eiweißablagerungen (Proteinaggregationen) in Nervenzellen bei der ALS. Teil dieses Forschungsprojektes ist Christopher Secker, der als experimentell tätiger Arzt bereits zu den Proteinablagerungen bei der Alzheimer-Erkrankung am MDC in Berlin gearbeitet hat. Seine Forschungserfahrungen und Methodenkenntnisse zur experimentellen Medizin, die er in der Alzheimer-Forschung erworben hat, bringt er in die ALS-Grundlagenforschung ein und entwickelt sie in Bezug auf die ALS weiter.
Mit der Forschungsgruppe hat er ein neuartiges Testverfahren entwickelt, mithilfe dessen die Akkumulation des TDP-43 Proteins und die Induktion bereits fehlgefalteter Proteine auf das lösliche Protein untersucht werden kann. Dazu werden TDP-43 Proteine beziehungsweise deren für die Aggregation maßgebenden, C-terminalen Fragmente an zwei verschiedene Fluoreszenzproteine gekoppelt. So kann die Zusammenlagerung der anfangs löslichen Proteine durch die Energieübertragung von einem TDP-43 Protein auf andere (Förster Resonance Energy Transfer – FRET) über die Zeit verfolgt werden. Je stärker die Akkumulation und je weniger lösliche TDP-43 vorliegen, desto stärker wird das Signal. Zusätzlich untersucht die Arbeitsgruppe, welchen Einfluss bereits fehlgefaltete ALS Proteine auf die Akkumulation löslicher TDP-43 Proteine haben um den Prozess der induzierten Fehlfaltung besser verstehen zu können.
Ziel dieses Ansatzes ist, die Dynamik der Proteinfehlfaltung bei der ALS zu charakterisieren und zu evaluieren, ob sich mithilfe dieses Verfahrens die Last an bereits fehlgefalteten TDP-43 Proteinen in betroffenen Patienten messen lässt. Dies könnte als Biomarker fungieren, um den Verlauf der ALS-Erkrankung biologisch zu monitoren und insbesondere in der Erprobung neuer Medikamente im Rahmen von Studien helfen, den Effekt der untersuchten Subtanzen auf die Ablagerung dieser Proteine zu beurteilen.
Da das neuartige Testverfahren auch Hochdurchsatz-kompatibel ist – es also in größerem Maßstab (teil-)automatisiert angewendet werden kann, testet das Forschungsteam auch ganze Substanzbibliotheken, um potenzielle Wirkstoffe zu identifizieren, die die Fehlfaltung und Akkumulation des TDP-43-Proteins verhindern können.

Abbildung 1: Verfolgung der TDP-Akkumulation mithilfe von Rasterkraftmikroskopie (links). Das entwickelte Testverfahren kann zuverlässig die Fehlfaltung und Zusammenlagerung über die Zeit messen.
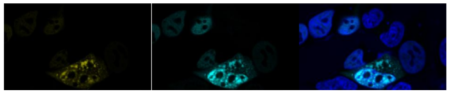
Abbildung 2: Eine von der TDP-Proteinablagerung betroffene Zelle unter dem Mikroskop. Mithilfe dieses zellbasierten Testsytems untersuchen wir die molekularen Ursachen der Proteinfehlfaltung und identifizieren mögliche Ansatzpunkte für eine kausale Therapie der ALS.
